Перейти к:
Сочетание папиллярной микрокарциномы щитовидной железы и диффузного токсического зоба у пациента с акромегалией
https://doi.org/10.14341/ket12723
Аннотация
Акромегалия — тяжелое мультифакториальное нейроэндокринное заболевание, сопровождающееся повышенной секрецией гормона роста, что способствует активной пролиферации клеток различных тканей в организме. Среди осложнений заболевания преобладает сердечно-сосудистая патология, которая нередко является причиной повышенной смертности. Однако в последнее время при акромегалии все чаще описываются случаи выявления рака щитовидной железы. Причины и рост распространенности доброкачественных и злокачественных новообразований щитовидной железы у пациентов с акромегалией вызывают многочисленные дебаты в медицинском мире. Рекомендации American Thyroid Association не включают акромегалию в список состояний с повышенным риском рака щитовидной железы, однако ряд экспериментальных и эпидемиологических данных указывает на высокую вероятность подобных осложнений.
Нами представлен клинический случай диагностированного папиллярного рака щитовидной железы и диффузного токсического зоба у пациентки с акромегалией.
Ключевые слова
Для цитирования:
Дзеранова Л.К., Ткачук А.В., Пигарова Е.А., Перепелова М.А., Ким И.В., Доровских А.В., Шутова А.С. Сочетание папиллярной микрокарциномы щитовидной железы и диффузного токсического зоба у пациента с акромегалией. Клиническая и экспериментальная тиреоидология. 2022;18(1):29-33. https://doi.org/10.14341/ket12723
For citation:
Dzeranova L.K., Tkachuk A.V., Pigarova E.A., Perepelova M.A., Kim I.V., Dorovskikh A.V., Shutova A.S. The combination of papillary thyroid microcarcinoma and diffuse toxic goiter in a patient with acromegaly. Clinical and experimental thyroidology. 2022;18(1):29-33. (In Russ.) https://doi.org/10.14341/ket12723
АКТУАЛЬНОСТЬ
Акромегалия — тяжелое мультифакториальное нейроэндокринное заболевание, обусловленное наличием аденомы гипофиза, в избытке продуцирующей гормон роста (ГР) и опосредуемый им инсулиноподобный фактор роста 1 (ИФР-1). Чрезмерное повышение ИФР-1 обусловливает развитие характерной клинической картины акромегалии: диспропорционального роста костей, хрящей, мягких тканей и внутренних органов, нарушения морфофункционального состояния сердечно-сосудистой системы, различных видов метаболизма. Широко известными свойствами ИФР-1, обусловливающими способность увеличивать пролиферативный потенциал клеток, являются его митогенная и антиапоптотическая активность. Возникновение новообразований щитовидной железы различного потенциала злокачественности, являясь яркой иллюстрацией избытка ИФР-1 в клинической картине акромегалии, представляется логичным и, в некоторой степени, закономерным осложнением этого нейроэндокринного заболевания. Однако одновременное сосуществование у пациента трех эндокринных патологий — акромегалии, папиллярного рака щитовидной железы (РЩЖ) и, неожиданно, диффузного токсического зоба (ДТЗ) — является исключительной редкостью и представляет значительный интерес.
Существует немало вопросов относительно достоверной оценки риска возникновения новообразований щитовидной железы у пациентов с акромегалией. В ряде исследований неоднократно показано увеличение частоты диффузного нетоксическогои узлового зоба при акромегалии. Однако данные, касающиеся дифференцированного РЩЖ, противоречивы. Часть исследователей отмечают повышение частоты возникновения злокачественных новообразований щитовидной железы у пациентов сакромегалией [1–3], в то время как другие работы демонстрируют равный риск в группах пациентов с акромегалией и без нее [4].
Информация о частоте сочетания ДТЗ и акромегалии весьма ограничена. Имеющиеся литературные источники свидетельствуют об отсутствии увеличения риска развития болезни Грейвса при акромегалии, более того, группа ученых под руководством Y. Cankurtaran отметила снижение частоты ДТЗ в группе пациентов с акромегалией относительно контрольной группы [4].
Каковы особенности диагностики и ведения пациентов в случае наличия всех трех описанных эндокринных патологий? В каком порядке следует проводить лечебные мероприятия, в том числе хирургического характера? Какой метод лечения патологии щитовидной железы следует считать предпочтительным? Описываемый нами редкий клинический случай сочетания ДТЗ и папиллярного РЩЖ у пациентки с акромегалией предлагает ответы на эти вопросы.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Пациентка 32 лет в 2020 г. госпитализирована в ФГБУ «НМИЦ эндокринологии» Минздрава России с жалобами на шум в ушах, акне, сухость кожных покровов, храп.
По данным анамнеза известно, что в 19 лет обнаружено увеличение объема щитовидной железы до 28 см3, при исследовании гормонального профиля — эутиреоз. В возрасте 22 лет отмечено увеличение размера обуви с 36 по 39, в 26 лет — увеличение кистей.
С 30 лет присоединились жалобы на учащенное сердцебиение, тремор пальцев рук, повышенную слабость, утомляемость, диффузную головную боль давящего характера, отсутствие менструаций, снижение веса на 5–6 кг. На магнитно-резонансной томографии (МРТ) головного мозга выявлена макроаденома гипофиза размерами 17×21×22 мм. Лабораторные исследования подтвердили наличие активной стадии акромегалии: соматотропный гормон в сыворотке крови — 19,3 нг/мл (0,06–6,9), ИФР-1 — 673,5 нг/мл (62–230), также отмечена гиперпролактинемия до 621,6 мМЕ/л (94–500) и тиреотоксикоз — тиреотропный гормон (ТТГ) 0,05 мМЕ/мл (0,25–3,5), свободный тироксин 24,78 пмоль/л (9–19). В 2020 г. инициирована терапия тиреостатическими препаратами 15 мг/сут с последующим снижением дозы до 10 мг/сут. После этого на протяжении двух лет контроль состояния щитовидной железы и гормонального статуса не проводился.
Осенью 2020 г. (в возрасте 30 лет) выполнена трансназальная аденомэктомия по поводу соматотропиномы, однако через 3 мес после оперативного вмешательства ремиссии акромегалии не наблюдалось, в связи с чем назначена терапия аналогами соматостатина (Сандостатин Лар с постепенной титрацией до максимальной дозы).
В ноябре 2021 г. пациентка госпитализирована в ФГБУ «НМИЦ эндокринологии» Минздрава России для определения тактики дальнейшего лечения. Прием тирозола в дозе 5 мг был отменен за 3 дня до госпитализации. Согласно данным лабораторного обследования подтверждено отсутствие ремиссии акромегалии, несмотря на проводимую терапию аналогами соматостатина в максимальной дозе (уровень ИФР-1 в сыворотке крови — 624 нг/мл (норма — 62–230), на МРТ головного мозга — остаточная ткань аденомы гипофиза размерами 5×8×10 мм с инфра- и параселлярным распространением). Проведен нейрохирургический консилиум, рекомендовано повторное оперативное вмешательство. Однако в рамках предоперационного обследования выявлены признаки тиреотоксикоза, обусловленного наличием болезни Грейвса: антитела к рецептору ТТГ 29,35 МЕ/л (0–1,75), ТТГ в сыворотке крови 1,12 мМЕ/л (0,25–3,5), трийодтиронин свободный 9,81 пмоль/л (2,6–5,7), тироксин св. 11,93 пмоль/л (9–19). Инициирован прием тирозола в дозе 30 мг в сутки с отменой за 1 день до тиреоидэктомии. По данным ультразвукового исследования щитовидной железы — увеличение общего объема до 80,9 см3, что соответствовало отрицательной динамике относительно исследования в январе 2021 г., когда объем железы составлял 38 см3. Выполнена сцинтиграфия, по данным которой отмечен повышенный захват радиофармацевтического препарата обеими долями щитовидной железы диффузного характера (индекс захвата 27,2%).
В ходе текущей госпитализации принято решение о порядке последующих лечебных мероприятий — признано целесообразным проведение в первую очередь тиреоидэктомии, после чего — повторной трансназальной аденомэктомии. Экстрафасциальная тиреоидэктомия выполнена в декабре 2021 г., послеоперационный период — без особенностей. При плановом морфологическом исследовании операционного материала ткань щитовидной железы представлена мелкими фолликулами неправильной формы со скудным коллоидом с вакуолями резорбции; фолликулярный эпителий гиперплазирован, тироциты с обильной светлой и светлой эозинофильной цитоплазмой; в строме щитовидной железы отмечаются расширенные полнокровные кровеносные сосуды, очаги лимфоидной инфильтрации с формированием лимфоидных фолликулов с герминативными центрами; на одном из гистологических срезов, в толще левой доли щитовидной железы, среди вышеописанных изменений отмечается рост неинкапсулированной папиллярной микрокарциномы диаметром 0,3 см, фолликулярного строения, без инвазии в капсулу доли щитовидной железы. Заключение: «Папиллярная микрокарцинома левой доли щитовидной железы, pT1aNxMx. Диффузный зоб щитовидной железы». Данные патоморфологического исследования щитовидной железы представлены на рис. 1.
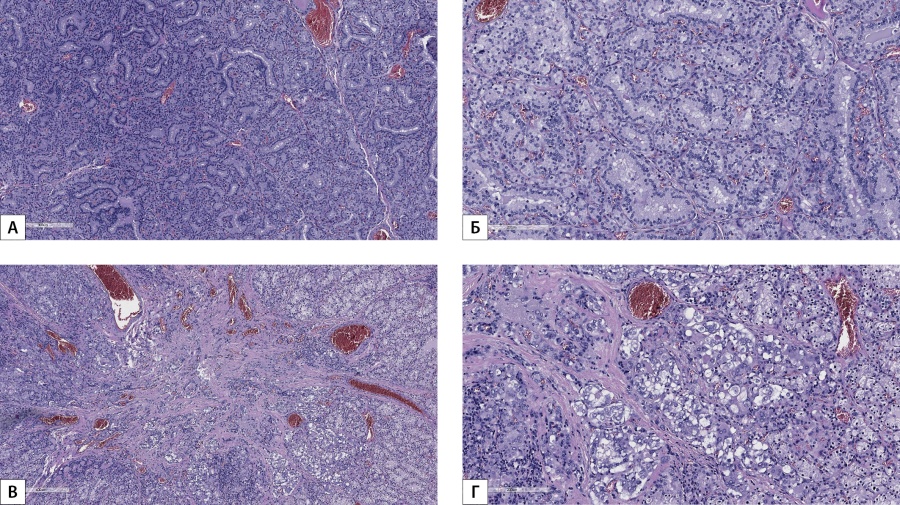
Рис. 1. Данные патоморфологического исследования щитовидной железы.
А, Б — фолликулы щитовидной железы неправильной формы со скудным содержанием коллоида, гиперплазированным фолликулярным эпителием (окраска гематоксилином и эозином, х400).
В, Г — неинкапсулированная папиллярная микрокарцинома щитовидной железы, фолликулярного строения (окраска гематоксилином и эозином, х400).
Fig. 1. Pathomorphological examination of the thyroid gland.
A, B — irregularly shaped thyroid follicles with poor colloid content, hyperplastic follicular epithelium (stained with hematoxylin and eosin, x400).
C, D — non-encapsulated papillary microcarcinoma of the thyroid gland, follicular structure (staining with hematoxylin and eosin, x400).
В послеоперационном периоде инициирована заместительная терапия левотироксином натрия в дозе 125 мкг в сутки.
В феврале 2022 г. проведено повторное трансназальное транссфеноидальное удаление эндо-инфраселлярной аденомы гипофиза. Данных за развитие вторичной надпочечниковой недостаточности, несахарного диабета не получено.
Пациентка выписана под наблюдение специалистов по месту жительства.
ОБСУЖДЕНИЕ
Распространенность карциномы щитовидной железы у пациентов с болезнью Грейвса, по данным различных источников, составляет от 2,3 до 21,1% [5][6]. Принято считать, что высокодифференцированная карцинома щитовидной железы как минимум в 2,5 раза чаще выявляется у пациентов с тиреотоксикозом, обусловленным ДТЗ, в сравнении с общей популяцией. В метаанализе 33 исследований, проведенном Staniforth J.U. и соавт., частота РЩЖ составила 0,07 случая [7].
Папиллярная карцинома щитовидной железы является наиболее распространенным гистологическим типом высокодифференцированного РЩЖ у пациентов с болезнью Грейвса (около 88%), однако встречаются и другие гистологические варианты, включая фолликулярную, медуллярную и анапластическую карциномы [7].
Длительное время считалось, что карциномы щитовидной железы, ассоциированные с болезнью Грейвса, характеризуются более агрессивным клиническим течением вследствие высокой концентрации тиреостимулирующих антител, вносящих вкладв рост и метастазирование опухоли [8]. Однако, согласно результатам последних исследований, повышенная концентрация NK-клеток (естественные киллеры) и макрофагов М1, обеспечивающих противоопухолевый иммунитет, а также устранение негативного влияния тиреостимулирующих антител вследствие хирургического лечения болезни Грейвса, способствуют лучшему прогнозу заболевания [9][10].
Увеличение выявляемости микрокарцином не является равным повышению выживаемости. Поэтому тактика ведения пациентов остается до сих пор дискутабельной. Некоторые авторы считают, что необходимо динамическое наблюдение [11], кто-торекомендует хирургическое лечение, ссылаясь на риск метастазирования [12][13]. При выборе тактики ведения необходимо учитывать все возможные интра- и послеоперационные осложнения, особенно у пациентов с тиреотоксикозом. Одно из редких,но грозных осложнений — тиреотоксический криз, смертность при котором оценивается в 8–25%, несмотря на современные достижения в его лечении и поддерживающих мерах. В нашем случае в связи с возможным возникновением данного осложнения пациентке в начале выполнена тиреоидэктомия перед удалением аденомы гипофиза.
Представленный клинический случай является наглядным примером сочетания акромегалии и поражения щитовидной железы, который подтверждает, что пациенты с этой патологией должны быть отнесены к повышенному риску развития РЩЖ.
В 2020 г. Yang L. et al. [14] изучили 73 образца ткани РЩЖ и с помощью иммуногистохимического анализа оценили экспрессию ИФР-1. По полученным результатам экспрессия ИФР-1 в образцах ткани РЩЖ была выше, чем в соседних нормальных образцах, и в значительной степени связана с размером опухоли, стадией TNM и метастазами в лимфатические узлы. Это позволило сделать вывод, что в совокупности ИФР-1 способствует пролиферации и инвазии, таким образом, прогрессированию РЩЖ через сигнальный путь STAT3. Ряд других исследований [15][16] подтверждают, что повышенный уровень ИФР-1 можно расценивать как диагностический и прогностический маркер развития РЩЖ.
В ранее проводимых исследованиях мы не выявили оценок корреляции темпа увеличения объема щитовидной железы и риска развития РЩЖ, что может являться одним из маркеров онкотрансформации.
В приводимом клиническом случае мы обратили внимание на взаимосвязь между быстрым темпом роста объема щитовидной железы и временем манифестации РЩЖ, на чем не был сделан акцент в ранее проведенных исследованиях. Быстрый темп роста объема щитовидной железы необходимо рассматривать при сопоставлении с экспрессией ИФР-1, что может являться одним из маркеров повышенного риска РЩЖ.
Учитывая повышенную вероятность РЩЖ у пациентов с акромегалией, необходимо продолжить анализ клинико-лабораторных проявлений случаев заболеваний, целью которых является установление информативных маркеров высокого риска РЩЖ. Решение этих задач позволит своевременно выявлять и планировать алгоритм эффективной помощи пациентам.
ЗАКЛЮЧЕНИЕ
Описанный нами клинический случай отражает некоторые новые представления возникновения РЩЖ у пациентов с акромегалией, заключающиеся в повышенной экспрессии ИФР-1, что способствует пролиферации и инвазии клеток и, таким образом, прогрессированию и метастазированию РЩЖ. В настоящее время наиболее целесообразным является обязательный скрининг состояния щитовидной железы у пациентов с акромегалией, требования к которому аналогичны таковому у общей популяции.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование проведено при финансовой поддержке Министерства здравоохранения Российской Федерации в рамках выполнения государственного задания «Эпидемиологические и молекулярно-клеточные характеристики опухолевых, аутоиммунных и йододефицитных тиреопатий как основа профилактики осложнений и персонализированного лечения», № НИОКТР AAAA-A20-120011790180-4.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Вклад авторов. Дзеранова Л.К. — получение, анализ данных, написание статьи; Ткачук А.В. — морфологическое исследование послеоперационного материала, написание статьи; Пигарова Е.А. — получение, анализ данных, внесение в рукопись важной правки; Перепелова М.А. — получение, анализ данных, написание статьи; Ким И.В. — проведение оперативного лечения, одобрение финальной версии рукописи; Шутова А.С. — получение, анализ данных, написание статьи; Доровских А.В. — получение, анализ данных, написание статьи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Согласие пациентки. Пациентка добровольно подписала информированное согласие на публикацию персональной медицинской информации в обезличенной форме в журнале «Клиническая и экспериментальная тиреоидология».
Список литературы
1. Gasperi M, Martino E, Manetti L, et al. Prevalence of thyroid diseases in patients with acromegaly: results of an Italian Multi-center Study. J Endocrinol Invest. 2002;25(3):240-245. doi: https://doi.org/10.1007/BF03343997
2. Tita P, Ambrosio MR, Scollo C, et al. High prevalence of differentiated thyroid carcinoma in acromegaly. Clin Endocrinol (Oxf ). 2005;63(2):161-167. doi: https://doi.org/10.1111/j.1365-2265.2005.02316.x
3. Uchoa HB de MP, Lima GAB, Corrêa LL, et al. Prevalence of thyroid diseases in patients with acromegaly: experience of a Brazilian center. Arq Bras Endocrinol Metabol. 2013;57(9):685-690. doi: https://doi.org/10.1590/S0004-27302013000900003
4. Cankurtaran Y, Örük GG, Tozduman B. Evaluation of thyroid disease and thyroid malignancy in acromegalic patients. Minerva Endocrinol. 2021;57(9):685-690. doi: https://doi.org/10.23736/S2724-6507.21.03363-7
5. Chen Y-K, Lin C-L, Chang Y-J, et al. Cancer Risk in Patients with Graves’ Disease: A Nationwide Cohort Study. Thyroid. 2013;23(7):879-884. doi: https://doi.org/10.1089/thy.2012.0568.
6. Kwon H, Moon B-I. Prognosis of papillary thyroid cancer in patients with Graves’ disease: a propensity scorematched analysis. World J Surg Oncol. 2020;18(1):266. doi: https://doi.org/10.1186/s12957-020-02044-x
7. Staniforth JUL, Erdirimanne S, Eslick GD. Thyroid carcinoma in Graves’ disease: A meta-analysis. Int J Surg. 2016;27:118-125. doi: https://doi.org/10.1016/j.ijsu.2015.11.027
8. Medas F, Erdas E, Canu GL, et al. Does hyperthyroidism worsen prognosis of thyroid carcinoma? A retrospective analysis on 2820 consecutive thyroidectomies. J Otolaryngol - Head Neck Surg. 2018;47(1):6. doi: https://doi.org/10.1186/s40463-018-0254-2
9. Dias Lopes NM, Mendonça Lens HH, Armani A, Marinello PC, Cecchini AL. Thyroid cancer and thyroid autoimmune disease: A review of molecular aspects and clinical outcomes. Pathol - Res Pract. 2020;216(9):153098. doi: https://doi.org/10.1016/j.prp.2020.153098;
10. Yoshioka W, Miyauchi A, Ito M, et al. Kinetic analyses of changes in serum TSH receptor antibody values after total thyroidectomy in patients with Graves disease. Endocr J. 2016;63(2):179-185. doi: https://doi.org/10.1507/endocrj.EJ15-0492
11. Miyauchi A, Ito Y. Conservative Surveillance Management of Low-Risk Papillary Thyroid Microcarcinoma. Endocrinol Metab Clin North Am. 2019;48(1):215-226. doi: https://doi.org/10.1016/j.ecl.2018.10.007
12. Luo Y, Zhao Y, Chen K, et al. Clinical analysis of cervical lymph node metastasis risk factors in patients with papillary thyroid microcarcinoma. J Endocrinol Invest. 2019;42(2):227-236. doi: https://doi.org/10.1007/s40618-018-0908-y
13. Page C, Biet A, Boute P, et al. ‘Aggressive papillary’ thyroid microcarcinoma. Eur Arch Oto-Rhino-Laryngology. 2009;266(12):1959-1963. doi: https://doi.org/10.1007/s00405-009-0952-5
14. Yang L, Tan Z, Li Y, et al. Insulin‐like growth factor 1 promotes proliferation and invasion of papillary thyroid cancer through the STAT3 pathway. J Clin Lab Anal. 2020;34(12):1959-1963. doi: https://doi.org/10.1002/jcla.23531
15. Pidchenko NS, Krasnoselskyi MV, Mitriaieva NA, et al. Insulinlike growth factors in the serum of patients with papillary thyroid cancer. Wiadomości Lek. 2021;74(8):1925-1930. doi: https://doi.org/10.36740/WLek202108126
16. Lawnicka H, Motylewska E, Borkowska M, et al. Elevated serum concentrations of IGF-1 and IGF-1R in patients with thyroid cancers. Biomed Pap. 2020;164(1):77-83. doi: https://doi.org/10.5507/bp.2019.018
Об авторах
Л. К. ДзерановаДзеранова Лариса Константиновна, д.м.н
eLibrary SPIN: 2958-555
Москва
А. В. Ткачук
Ткачук Арина Вадимовна
eLibrary SPIN: 8825-8874
Москва
Е. А. Пигарова
Пигарова Екатерина Александровна, д.м.н.
eLibrary SPIN: 6912-6331
Москва
М. А. Перепелова
Россия
Перепелова Маргарита Александровна, клинический ординатор
117036, Москва, ул. Дмитрия Ульянова, д. 11, к. 2
eLibrary SPIN: 8950-0673
И. В. Ким
Ким Илья Викторович, к.м.н.
eLibrary SPIN: 7409-6123
Москва
А. В. Доровских
Доровских Анна Владимировна
Москва
А. С. Шутова
Шутова Александра Сергеевна
eLibrary SPIN 4774-0114
Москва
Дополнительные файлы
|
|
1. Рис. 1. Данные патоморфологического исследования щитовидной железы | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(1MB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Дзеранова Л.К., Ткачук А.В., Пигарова Е.А., Перепелова М.А., Ким И.В., Доровских А.В., Шутова А.С. Сочетание папиллярной микрокарциномы щитовидной железы и диффузного токсического зоба у пациента с акромегалией. Клиническая и экспериментальная тиреоидология. 2022;18(1):29-33. https://doi.org/10.14341/ket12723
For citation:
Dzeranova L.K., Tkachuk A.V., Pigarova E.A., Perepelova M.A., Kim I.V., Dorovskikh A.V., Shutova A.S. The combination of papillary thyroid microcarcinoma and diffuse toxic goiter in a patient with acromegaly. Clinical and experimental thyroidology. 2022;18(1):29-33. (In Russ.) https://doi.org/10.14341/ket12723

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).






































