Перейти к:
Исследование галектина-3, Ki-67, убиквитина, HMGA2 методом полимеразной цепной реакции в режиме реального времени в пункционном материале при узловом зобе
https://doi.org/10.14341/ket2016219-27
Аннотация
Актуальность. Существует проблема в проведении дифференциального диагноза фолликулярной аденомы, фолликулярного варианта папиллярного рака и фолликулярного рака щитовидной железы (РЩЖ). Для этой цели апробировано нескольких молекулярных маркеров, однако ценность их применения различна.
Цель: количественное определение мРНК маркеров-кандидатов высокодифференцированного РЩЖ (галектина-3, Ki-67, убиквитина, HMGA2) методом полимеразной цепной реакции в режиме реального времени (РТ-ПЦР) в пунктируемом материале из узлов щитовидной железы (ЩЖ). Установить значимость данного метода исследования для диагностики злокачественных новообразований в ЩЖ на дооперационном этапе.
Материал и методы. В исследование включено 55 пациентов с клиническим диагнозом узлового/многоузлового зоба. На пункционном материале проводился количественный анализ мРНК галектина-3, Ki-67, убиквитина, HMGA2 при помощи обратной транскрипции и РТ-ПЦР. Результаты ПЦР анализировали с помощью метода максимума второй производной (Second Derivative Maximum Method).
Результаты. В исследовании участвовало 46 женщин (83,6%) и 8 мужчин (14,5%). Средний возраст пациентов составил 52,1 года (от 23 до 82 лет). По результатам гистологического исследования, доброкачественных образований было 35 (63,6%), злокачественных (представлены папиллярным раком) – 20 (36,4%). В структуре гистологических заключений фолликулярного рака не встретилось. После проведения ПЦР были найдены значимые различия в экспрессии мРНК гена убиквитина между злокачественными и доброкачественными узловыми образованиями ЩЖ.
Заключение. Значение мРНК гена убиквитина 8,24 по результатам РТ-ПЦР обладало чувствительностью 68,4% и специфичностью 68,6% в диагностике высокодифференцированного рака на этапе проведения ТАБ-УЗИ. Исследование мРНК генов Ki-67, галектина-3, HMGA при помощи РТ-ПЦР не показало себя надежным методом для дифференциальной диагностики узлов ЩЖ на предоперационном этапе.
Ключевые слова: рак щитовидной железы, узловое образование, ПЦР, ПЦР в режиме реального времени, маркеры рака, галектин-3, Ki-67, убиквитин, HMGA2.
Ключевые слова
Для цитирования:
Березкина И.С., Саприна Т.В., Зима А.П., Исаева А.В., Латыпова В.Н., Мухамедов М.Р., Базилевич Л.Р., Попов О.С., Скуратовская Д.А., Юрова К.А., Литвинова Л.С. Исследование галектина-3, Ki-67, убиквитина, HMGA2 методом полимеразной цепной реакции в режиме реального времени в пункционном материале при узловом зобе. Клиническая и экспериментальная тиреоидология. 2016;12(2):19-27. https://doi.org/10.14341/ket2016219-27
For citation:
Berjozkina I.S., Saprina T.V., Zima A.P., Isaeva A.V., Latipova V.N., Muhamedov M.R., Bazilevich L.R., Popov O.S., Skuratovskaja D.A., Jurova K.A., Litvinova L.C. The study of galectin-3, Ki-67, ubiquitin, HMGA-2 by polymerase chain reaction in real time (RT-PCR) in the puncture specimens of nodular goiter. Clinical and experimental thyroidology. 2016;12(2):19-27. (In Russ.) https://doi.org/10.14341/ket2016219-27
Введение
До сих пор проблема дифференциальной диагностики доброкачественных и злокачественных узловых образований щитовидной железы (ЩЖ) остается актуальной и является причиной выполнения большого количества “лишних” оперативных вмешательств, доля которых, по данным разных авторов, достигает 71% [1]. Также проблемой является невозможность различить при традиционном цитологическом исследовании фолликулярную аденому, фолликулярный вариант папиллярного рака и фолликулярный рак щитовидной железы (РЩЖ), т.е. провести дифференциальный диагноз между этими нозологиями. Для этой цели апробировано несколько молекулярных маркеров, однако ценность их применения, по данным различных исследований, отличается в зависимости не только от самого маркера, но и метода его определения.
Один из методов – полимеразная цепная реакция (ПЦР) позволяет нарабатывать в пробирке определенный участок молекулы дезоксирибонуклеиновой кислоты (ДНК) практически в неограниченных количествах. Кроме того, ПЦР в режиме реального времени (РТ-ПЦР) дает возможность регистрировать продукты непосредственно в ходе реакции и получать калибровочные графики для процесса амплификации, происходящего в каждой отдельной пробирке во время каждого цикла на протяжении всего времени проведения анализа. Метод применяют в клинической медицине для диагностики инфекционных и наследственных заболеваний, при диагностике рака и иммунных патологий. В ходе ПЦР возможна наработка ДНК даже с единственной матричной молекулы [2]. Таким образом, для проведения ПЦР можно использовать любой биологический материал: кровь, слюну, мочу, материал, полученный при соскобах, пункционной биопсии. Метод ПЦР применяют, в частности, для диагностики рака шейки матки, легкого, молочной железы, лимфом.
Существует большое количество исследований, посвященных изучению особенностей молекулярных и генетических изменений, происходящих в узловых образованиях ЩЖ, однако до сих пор не существует маркера, который бы применялся в клинической практике для дооперационной верификации РЩЖ. Так, наша группа исследовала возможность иммуноцитохимической детекции таких маркеров как галектин-3, Ki-67, NFM при РЩЖ и известный маркер пролиферации Ki-67, который показал себя достаточно эффективным для диагностики злокачественной патологии на дооперационном этапе [3]. Мы решили продолжить исследование в данном направлении, применив другой способ диагностики – РТ-ПЦР. Ниже приводим известную на сегодняшний день информацию по анализу онкомаркеров данным методом.
Галектин-3 – многофункциональный белок семейства лектинов, который принимает участие в межклеточных, клеточно-матриксных взаимоотношениях, играет роль в опухолевой прогрессии, апоптозе, ангио- и васкулогенезе, метастатическом потенциале. Ряд ученых полагают, что измерение количественного уровня мРНК галектина-3 не имеет клинического значения для дифференциальной диагностики доброкачественной и злокачественной патологии [4–6]. Возможно, такая ситуация связана с деградацией мРНК [4]. А возможно, и с тем, что макрофаги и активированные эндотелиальные клетки экспрессируют данный маркер [7]. Однако во многих исследованиях галектина-3 методом иммуногистохимии его экспрессия значимо повышалась при злокачественной патологии в ЩЖ [4].
Убиквитин регулирует вступление клетки в анафазу и выход из митоза в совокупности с комплексом стимуляции анафазы [8]. Методом проточной цитометрии показано, что экспрессия данного маркера зависит от клеточного цикла, неуклонно растет в фазе S, достигая максимума в G (2) / M фазе, и резко уменьшается в G (0) / G (1) фазе [9]. Что касается исследований по убиквитину методом ПЦР, то их немного. Так, показано, что убиквитин необходимо включать в панель маркеров РЩЖ при дооперационном исследовании, так как количество мРНК его гена значимо выше при раке, чем при доброкачественном процессе, а значение ΔСt убиквитина менее 4,02 обладает чувствительностью 72%, специфичностью 67% для диагностики фолликулярной аденомы в случае цитологической постановки заключения “фолликулярная неоплазия” или “подозрение на фолликулярный рак” [10].
Исследователи отмечают большое значение изучения индекса пролиферативной активности в дифференциальной диагностике фолликулярных аденом и карцином. В нескольких работах [11, 12] была показана выраженная экспрессия Ki-67 при иммуногистохимическом исследовании в злокачественных новообразованиях ЩЖ, в том числе и в образцах фолликулярного рака в отличие от доброкачественного процесса. Так, была определена значимость иммуноцитохимического исследования маркера Ki-67 в диагностике высокодифференцированного РЩЖ, используя в том числе метод жидкостной цитологии. Чувствительность определения Ki-67 (n = 54) составила 85,0%, специфичность – 70,6%, при этом отрезной точкой (cut-off) считался 1% позитивных клеток [13]. Исследований методом РТ-ПЦР транскрипта Ki-67 у пациентов с высокодифференцированным РЩЖ в литературе нам не встретилось.
Около 30 лет назад было предложено использовать для дифференциальной диагностики уровень экспрессии белка HMGA (high mobility group A) как важного опухолевого маркера в диагностике злокачественных новообразований [14]. HMGA-белки кодируются двумя генами, HMGA1 и HMGA2, расположенными на хромосомах 6p21 и 12q13-15 соответственно. Два этих гена выраженно экспрессируются на эмбриональном этапе развития, в то время как в ткани взрослого организма присутствуют в небольшом количестве [15, 16]. Однако была показана гиперэкспрессия данного белка и в злокачественных опухолях человека [17–20].
На залитых парафином образцах ткани было показано, что уровень мРНК HMGA2 в злокачественных новообразованиях ЩЖ был значительно выше, чем в нормальной ткани ЩЖ и ткани аденомы [21, 22]. Причем значение мРНК HMGA2 выше 3,99 с чувствительностью 95,9% и специфичностью 93,9% свидетельствует о злокачественности процесса, а значение мРНК маркера 6,3 позволяло с чувствительностью 81,2% и специфичностью 88,3% диагностировать фолликулярный РЩЖ в случае неопределенного цитологического заключения “фолликулярная неоплазия” [21]. Имеются исследования, где материалом служил пунктируемый материал из узлов ЩЖ. Например, было показано, что нормальные клетки ЩЖ и аденомы экспрессируют низкие уровни мРНК HMGA2 по сравнению с папиллярным и фолликулярным раком [23–25]. Самая высокая чувствительность и специфичность определения HMGA2 методом РТ-ПЦР была в исследовании L. Jin и соавт. [25] – 90,2 и 97,1% соответственно для дооперационной диагностики РЩЖ. В исследовании P.J. Lappinga и соавт. [23] было показано, что отрезная точка 5,9 и выше уровня мРНК HMGA2 позволяет с чувствительностью 71% и специфичностью 97% обнаружить высокодифференцированный РЩЖ до операции. Другие авторы [26] считают, что экспрессия HMGA2, действительно, выше при фолликулярном раке или фолликулярном варианте папиллярного рака, что, однако, не позволяет с высокой точностью отличить их от фолликулярной аденомы. Другой метод определения данного маркера для дифференциальной диагностики злокачественной и доброкачественной патологии не показал высокой значимости: иммуногистохимическое исследование HMGA2 продемонстрировало возможность дифференцировать фолликулярный рак от фолликулярной аденомы и аденоматозного зоба, однако с невысокой чувствительностью метода – 55,7%, специфичностью 64,6%, кроме того, данный маркер не мог позволить отличить фолликулярную аденому от фолликулярного рака ЩЖ [27].
Таким образом, результаты исследования экспрессии белков отличаются от результатов исследования их генов. Однако исследование мРНК некоторых генов методом РТ-ПЦР может применяться в клинической практике для диагностики злокачественных новообразований ЩЖ.
Цель
Количественное определение мРНК маркеров-кандидатов высокодифференцированного РЩЖ (галектина-3, Ki-67, убиквитина, HMGA2) методом РТ-ПЦР в пунктируемом материале из узлов щитовидной железы. Установить значимость данного метода исследования для диагностики злокачественных новообразований в щитовидной железе на этапе проведения тонкоигольной аспирационной биопсии под контролем ультразвукового исследования (ТАБ-УЗИ).
Материал и методы
В исследование включено 55 пациентов с клиническим диагнозом узлового/многоузлового зоба. Проводился анализ клинических и лабораторных параметров (общий и биохимический анализы крови, тиреотропный гормон, свободный тироксин, антитела к тиреопероксидазе, данные УЗИ). Всем пациентам по показаниям была выполнена ТАБ-УЗИ с последующим традиционным цитологическим исследованием. Также была взята отдельно пункция, материал из которой был помещен в пробирку типа Eppendorf c раствором Preservative Solution Novaprep, в последующем разделенный для проведения жидкостной цитологии и ПЦР. Результаты дооперационных цитологических исследований были распределены по классификации Бетесда 2009 г. [28]. На пункционном материале проводился количественный анализ мРНК галектина-3, Ki-67, убиквитина, HMGA2 при помощи обратной транскрипции и ПЦР в режиме реального времени. Результаты ПЦР анализировали с помощью метода максимума второй производной (Second Derivative Maximum Method), т.е. определения значения некоторой характеристической точки Cp (Сrossing point) на графике накопления ДНК по форме кривой. Расчеты уровней относительной экспрессии исследуемых генов производили с помощью формулы: 2 - ΔCp (ΔCp = Cp интересующего гена – Cp гена “внутреннего контроля”). Полученное число для удобства работы было умножено на 1000 [29].
В исследовании принимали участие пациенты с узловой патологией ЩЖ, которым было показано проведение ТАБ-УЗИ и предстояло оперативное лечение на данном органе, подписавшие информированное согласие. Все пациенты соответственно установленным клиническим показаниям были прооперированы. Результаты окончательного диагноза выставлялись согласно гистологическому заключению.
Критериями исключения пациентов из программы исследования являлись наличие низкодифференцированного, анапластического или медуллярного рака щитовидной железы, отсутствие пунктата, взятого из узла щитовидной железы, а также отказ от участия в исследовании. Исследование соответствовало требованиям локального этического комитета ГБОУ ВПО СибГМУ Минздрава России (регистрационный № 3558, дата проведения заседания – 23.12.2013). Исследование мРНК генов методом РТ-ПЦР было выполнено на базе лаборатории иммунологии и клеточных биотехнологий ФГАОУ ВО “БФУ им. И. Канта” г. Калининграда.
Статистическая обработка данных проводилась в программе SPSS Statistics 20. Описание количественных признаков, не соответствующих нормальному закону распределения, представлено в виде медианы и межквартильного размаха (Me(Q1–Q3)). Для проверки закона распределения признаков проводился тест Колмогорова–Смирнова. Сравнение двух независимых выборок по количественному признаку проводилось при помощи критерия Манна–Уитни, анализ качественных признаков проводился при помощи критерия χ2 и точного критерия Фишера. Для корреляционного анализа проводился расчет коэффициента Спирмена. Критический уровень значимости в работе принят равным 0,05. Для расчета диагностической эффективности (величины порогового значения, показателей чувствительности, специфичности) применяли ROC-анализ.
Результаты исследования
В исследование включено 46 женщин (83,6%) и 8 мужчин (14,5%). Средний возраст пациентов составил 52,1 года (от 23 до 82 лет). Распределение пациентов по окончательному гистологическому диагнозу представлено в табл. 1. В исследуемой выборке наиболее часто регистрировались узловой зоб (30,9%) и фолликулярная аденома (27,3%). Аутоиммунный тиреоидит (АИТ) встречался как самостоятельная патология в 25% случаев и в 33,3% – в сочетании с папиллярным раком ЩЖ (табл. 2).
Таблица 1. Структура постоперационного гистологического заключения
Гистологические заключения | Количество, n (%) |
Узловой зоб (коллоидный/пролиферирующий/паренхиматозный) | 17 (30,9%) |
АИТ | 12 (5,4%)– как самостоятельный процесс, 9 – в сочетании с другой патологией |
Фолликулярная аденома | 15 (27,3%) |
Папиллярный рак | 20 (36,4%) |
Всего | 55 (100%) |
Доброкачественные образования | 35 (63,6%) |
Злокачественные образования | 20 (36,4%) |
Таблица 2. Распределение случаев АИТ как самостоятельного процесса или в сочетании с другой патологией щитовидной железы
АИТ | Количество, n(%) | Количество, n(%) |
Как самостоятельный процесс | 3 (25%) | F=10,7 p=0,019 |
В сочетании с узловым зобом | 3 (25%) | |
В сочетании с фолликулярной аденомой | 2 (16,6%) | |
В сочетании с папиллярным раком | 4 (33,3%) | |
Всего | 12 (100%) |
Высокодифференцированный рак (был представлен папиллярным) регистрировался в 20 (36,4%) случаях. Фолликулярный рак в нашей выборке не встретился. Распределение по полу показало, что папиллярный рак как у женщин (34%), так и у мужчин (50%) встречался одинаково часто (χ2 = 0,752, р = 0,386). В 4 из 20 случаев (20%) встречался фолликулярный вариант папиллярного рака.
Папиллярный рак по стадиям согласно классификации UICC/AJCC 2002 г. [30] был распределен следующим образом: I стадия – 11 случаев (57%), II стадия – 4 (21,1%), III стадия – 4 случая (21,1%). Таким образом, пациенты в большинстве случаев были включены в исследование и прооперированы на I стадии высокодифференцированного рака.
Сопоставление заключений дооперационного метода исследования с окончательным (гистологическим) диагнозом представлено в табл. 3.
Таблица 3. Сопоставление традиционного цитологического и гистологического заключений
Категория Бетесда | Соответствие гистологическому заключению | Кол-во случаев | % от общего числа | % заключений о злокачественности процесса в каждой категории |
I | Узловой зоб | 5 | 9% | 0% |
АИТ | 1 | 1,8% | ||
Фолликулярная аденома | 2 | 3,6% | ||
II | Узловой зоб | 9 | 16,4% | 14,3% |
Фолликулярная аденома | 3 | 5,4% | ||
Папиллярный рак | 2 | 3,6% | ||
III | Папиллярный рак | 3 | 5,4% | 100% |
IV | Узловой зоб | 3 | 5,4% | 18,7% |
АИТ | 1 | 1,8% | ||
Фолликулярная аденома | 9 | 16,4% | ||
Папиллярный рак | 3 | 5,4% | ||
V | АИТ | 1 | 1,8% | 75% |
Фолликулярная аденома | 1 | 1,8% | ||
Папиллярный рак | 6 | 11% | ||
VI | Папиллярный рак | 6 | 11% | 100% |
Всего | 100% |
После проведения ПЦР были найдены значимые различия в экспрессии мРНК гена убиквитина между злокачественными и доброкачественными узловыми образованиями ЩЖ, содержание же мРНК остальных генов статистически значимо не различалось между таковыми у пациентов с доброкачественными и злокачественными образованиями ЩЖ (табл. 4).
Таблица 4. Результаты исследования мРНК генов в доброкачественном и злокачественном образовании щитовидной железы
Маркер | Уровень мРНК в доброкачественные образования (n=35), Ме(Q1-Q3) | Уровень мРНК в злокачественном образовании (n= 20), Ме(Q1-Q3) | Значимость | |
U | Р | |||
Галектин-3 | 39,5 (27,5-70,5) | 51,8 (41,3-69,7) | U=249 | р=0,284 |
Ki-67 | 5,1 (2,1-14,0) | 2,6 (0,9-5,6) | U=189,0 | р=0,185 |
Убиквитин | 7,0 (4,5-9,3) | 9,6 (5,1-26,4) | U= 195 | р=0,013 |
HMGA-2 | 25,1 (17,8-34,3) | 21,1(16,2-31,1) | U=326,0. | р=0,906 |
Методом ROC-анализа было установлено, что значение мРНК убиквитина 8,24 обладало чувствительностью 68,4% и специфичностью 68,6% в диагностике высокодифференцированного рака на этапе проведения ТАБ-УЗИ. Площадь под кривой составила 0,7 (p = 0,013).
Было выдвинуто предположение, что экспрессия мРНК генов может возрастать с увеличением стадии РЩЖ, однако значимого тренда (корреляционный анализ) не было выявлено ни с одним из маркеров.
Нами также было проведено сравнение медианы мРНК генов с учетом результатов гистологического диагноза (рисунок).
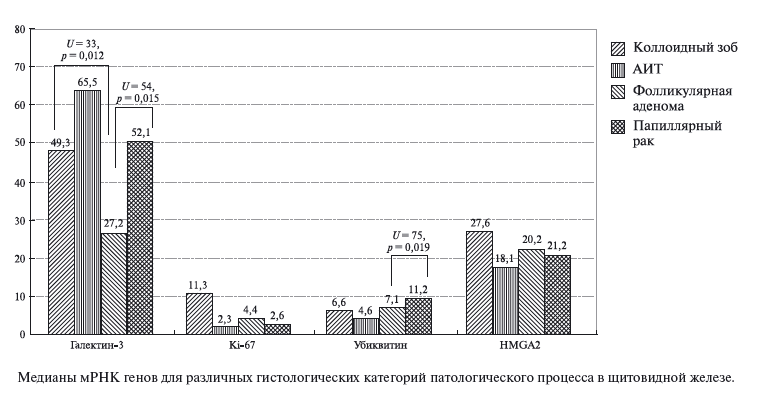
Значимо низкий уровень мРНК галектина-3 выявлялся при фолликулярной аденоме по сравнению с аналогичным показателем у пациентов с коллоидным зобом и папиллярным раком. Значение транскрипта убиквитина также было значимо ниже при фолликулярной аденоме в сравнении со злокачественным процессом. Методом ROC-анализа была установлена отрезная точка значения мРНК убиквитина – 8,24, которая позволяет с чувствительностью 68,4%, специфичностью 86,7% дифференцировать папиллярный рак от фолликулярной аденомы (площадь под кривой 0,74, р = 0,019).
Нами также было сделано предположение о возможных значимых различиях уровня маркеров в пунктатах щитовидной железы при фолликулярной аденоме и фолликулярном варианте папиллярного рака, дифференциальная диагностика которых затруднительна при проведении традиционного цитологического исследования, однако значимой разница между экспрессией мРНК при этих двух нозологиях не оказалась. Однако в образцах с классической формой папиллярного рака уровень мРНК галектина-3 был значимо выше 54,9 (48,8–125,7), чем при фолликулярном варианте папиллярного РЩЖ – 43,1 (1,7–48,4), U = 8, р = 0,028 (табл. 5).
Таблица 5. Уровень мРНК гена при классическом и фолликулярном варианте папиллярного рака щитовидной железы, Ме(Q1-Q3)
Ген | Уровень мРНК при классическом варианте папиллярного рака (n=16) | Уровень мРНК при фолликулярном варианте папиллярного рака (n=4) | Значимость | |
U | Р | |||
Галектин-3 | 54,9 (48,8-125,7) | 43,0 (13,7-48,4) | U=8 | р=0,028, |
Ki-67 | 1,7 (0,54 -13,3) | 2,7 (1,4-4,9) | U=24 | р=1,000 |
Убиквитин | 13,1 (6,4-26,4) | 7,3 (2,3-29308,9) | U=23 | р=0,484, |
HMGA2 | 24,2 (18,6-36,0) | 17,3 (11,9-25,0) | U=15 | р=0,134, |
Была проверена гипотеза, что уровень мРНК генов может прогрессивно увеличиваться по мере увеличения тяжести патологического процесса от доброкачественного образования до аденомы и рака. Ниже (табл. 6) представлены результаты медианы мРНК исследуемых маркеров при коллоидном зобе и АИТ (доброкачественном процессе), фолликулярной аденоме и папиллярном раке.
Таблица 6. Значение мРНК онкомаркеров при различных патоморфологических процессах в щитовидной железе, Ме(Q1-Q3)
Результат гистологического исследования | мРНК гал-3 | мРНК Ki-67 | мРНК убиквитина | мРНК HMGA |
Доброкачественное образование | 55,6 (35,7-126,5) | 10,5 (2,3-17,7) | 6,5 (2,6-10,0) | 26,3 (16,7-35,1) |
Аденома | 27,1 (24,8-33,7) | 4,4 (1,2-10,1) | 7,0 (4,5-7,8) | 20,2 (17,2-33,6) |
Рак | 52,1 (41,3-91,5) | 2,6(0,9-10,1) | 11,2(6,4-20,4) | 21,2 (16,2-31,1) |
Корреляция, R (р) | R= -0,048 (р=0,740) | R= -0,253 (р=0,086) | R= 0,262 (р=0,056) | R= -0,054 (р=0,696) |
Значимость, Н (р) | Н=9,602 (р=0,008) | Н=3,082 (р=0,214) | Н=6,561 (р=0,038) | Н=0,391 (р=0,822) |
Прогрессивное увеличение значения мРНК от доброкачественного процесса до карциномы было обнаружено только для гена убиквитина, однако эта корреляция не являлась значимой. При исследовании мРНК остальных генов такого постепенного увеличения экспрессии по мере возрастания тяжести патологического процесса выявлено не было.
Также проведен анализ экспрессии мРНК генов в зависимости от наличия аутоиммунного процесса в щитовидной железе и не обнаружено достоверных различий уровня мРНК маркеров в зависимости от хронического воспалительного процесса.
Уровень мРНК маркеров не показал корреляции ни с возрастом пациента, ни с длительностью заболевания, ни с размером образования.
Также был проведен корреляционный анализ между показателями мРНК маркеров. Была найдена значимая слабая положительная корреляция межу уровнем мРНК убиквитина и Ki-67, HMGA2 и Ki-67, галектином-3 и HMGA2, прямая корреляционная зависимость средней силы между HMGA2 и убиквитином. Не было найдено корреляции между мРНК галектина-3 и Ki-67, а также галектина-3 и убиквитином (табл. 7).
Таблица 7. Корреляционная зависимость между уровнями м РНК генов в различных группах пациентов
Корреляционная взаимосвязь | ||||||||||
Пара маркеров | В общей группе пациентов | В группе с РЩЖ | В группе доброкачественных образований ЩЖ | АИТ (+) | АИТ (-) | |||||
Р | р | Р | р | Р | р | Р | р | Р | р | |
Гал-3- Ki-67 | 0,161 | 0,280 | -0,071 | 0,795 | 0,280 | 0,127 | 0,118 | 0,729 | 0,210 | 0,219 |
Гал-3-Ubсh | 0,209 | 0,146 | 0,232 | 0,354 | 0,060 | 0,742 | 0,056 | 0,863 | 0,233 | 0,158 |
Гал-3-HMGA2 | 0,372 | 0,008 | 0,639 | 0,004 | 0,319 | 0,075 | 0,210 | 0,513 | 0,462 | 0,003 |
Ki-67- Ubсh | 0,304 | 0,040 | 0,154 | 0,585 | 0,458 | 0,010 | 0,127 | 0,709 | 0,338 | 0,047 |
Ki-67- HMGA2 | 0,421 | 0,004 | 0,361 | 0,187 | 0,363 | 0,045 | 0,655 | 0,029 | 0,385 | 0,022 |
Ubсh- HMGA2 | 0,541 | 0,000 | 0,556 | 0,013 | 0,548 | 0,001 | 0,533 | 0,061 | 0,536 | 0,000 |
Корреляционный анализ подтвердил первоначальную гипотезу о том, что связи между маркерами могут отличаться в зависимости от сопутствующего аутоиммунного процесса: при сопутствующем АИТ была найдена только одна значимая прямая корреляционная зависимость средней силы – между уровнем мРНК Ki-67 и HMGA2 (Р = 0,655, р = 0,029). В то время как без аутоиммунного процесса корреляционная зависимость полностью сохраняется, как и в общей группе пациентов: значимая слабая положительная корреляция между уровнем мРНК убиквитина и Ki-67, HMGA2 и Ki-67, галектином-3 и HMGA2, прямая корреляционная зависимость средней силы между HMGA2 и убиквитином.
Выводы
1. Количественный анализ мРНК гена убиквитина методом РТ-ПЦР в пункционном материале ТАБ-УЗИ позволяет выявить высокодифференцированный рак щитовидной железы с чувствительностью 68,4% и специфичностью 68,6% (р = 0,013).
2. Исследование мРНК генов Ki-67, галектина-3, HMGA методом РТ-ПЦР не показало себя надежным методом для дифференциальной диагностики узловой патологии щитовидной железы на предоперационном этапе.
Информация о финансировании и конфликте интересов
Исследования выполнены при поддержке Гранта совета при Президенте РФ для поддержки ведущих научных школ (№ НШ-4184.2014.7), Гранта совета при Президенте РФ для поддержки молодых докторов наук (№ 16.120.11.1233-МД).
Все авторы заявляют об отсутствии потенциальных и явных конфликтов (двойственности) интересов, связанных с публикацией данной статьи.
Вклад авторов
Березкина И.С. – сбор и обработка материалов, анализ полученных данных, написание текста; Саприна Т.В. – концепция и дизайн исследования, анализ полученных данных, написание и редактирование текста; Зима А.П. – концепция и дизайн исследования; Исаева А.В. – сбор и обработка материалов; Латыпова В.Н. – сбор информации; Мухамедов М.Р. – сбор информации; Базилевич Л.Р. – сбор информации; Попов О.С. – сбор информации;
Скуратовская Д.А. – проведение ПЦР-диагностики; Юрова К.А. – проведение ПЦР-диагностики; Литвинова Л.С. – проведение ПЦР-диагностики.
Список литературы
1. Bartolazzi A, Orlandi F, Saggiorato E, et al. Galectin-3-expression analysis in the surgical selection of follicular thyroid nodules with indeterminate fine-needle aspiration cytology: a prospective multicentre study. The Lancet Oncology. 2008;9(6):543-549. doi: 10.1016/s1470-2045(08)70132-3.
2. Ребриков Д.В., Саматов Г.А., Трофимова Д.Ю., и др. ПЦР “в реальном времени” / Под ред. Ребрикова Д.В. – М.: Издательство БИНОМ; 2009. [Rebrikov DV, Samatov GA, Trofimova DJ, et al. PCR “real-time”. Ed by Rebrikov D.V. Moscow: BINOM; 2009 (in Russ.)].
3. Березкина И.С., Саприна Т.В., Зима А.П., и др. Возможности традиционной и жидкостной цитологии в сочетании с иммуноцитохимической детекцией некоторых молекулярных маркеров в дооперационной диагностике высокодифференцированного рака щитовидной железы. // Клиническая и экспериментальная тиреоидология. – 2016. – Т.12. – №1. – С. 38–45. [Berjozkina IS, Saprina TV, Zima AP, et al. Possibilities traditional and liquid-based cytology combined with immunocytochemical detection of some molecular markers in the preoperative diagnosis of well-differentiated thyroid cancer. Clinical and experimental thyroidology. 2016;12(1):38-45. (in Russ.)]. doi: 10.14341/ket2016138-45.
4. Feilchenfeldt J, Totsch M, Sheu SY, et al. Expression of galectin-3 in normal and malignant thyroid tissue by quantitative PCR and immunohistochemistry. Mod Pathol. 2003;16(11):1117-1123. doi: 10.1097/01.MP.0000096047.99202.31.
5. Martins L, Matsuo SE, Ebina KN, et al. Galectin-3 messenger ribonucleic acid and protein are expressed in benign thyroid tumors. J Clin Endocrinol Metab. 2002;87(10):4806-4810. doi: 10.1210/jc.2002-020094.
6. Samija I, Matesa N, Lukac J, Kusic Z. Galectin-3 and CD44v6 as markers for preoperative diagnosis of thyroid cancer by RT-PCR. Diagn Mol Pathol. 2011;20(4):233-241. doi: 10.1097/PDM.0b013e31821a59f1.
7. Bartolazzi A, Gasbarri A, Papotti M, et al. Application of an immunodiagnostic method for improving preoperative diagnosis of nodular thyroid lesions. Lancet. 2001;357(9269):1644-1650. doi: 10.1016/S0140-6736(00)04817-0.
8. Lin Y, Hwang WC, Basavappa R. Structural and functional analysis of the human mitotic-specific ubiquitin-conjugating enzyme, UbcH10. J Biol Chem. 2002;277(24):21913-21921. doi: 10.1074/jbc.M109398200.
9. Jiang L, Bao Y, Luo C, et al. Knockdown of ubiquitin-conjugating enzyme E2C/UbcH10 expression by RNA interference inhibits glioma cell proliferation and enhances cell apoptosis in vitro.J Cancer Res Clin Oncol. 2010;136(2):211-217. doi: 10.1007/s00432-009-0651-z.
10. Guerriero E, Ferraro A, Desiderio D, et al. UbcH10 expression on thyroid fine-needle aspirates. Cancer Cytopathol. 2010;118(3): 157-165. doi: 10.1002/cncy.20046.
11. Choudhury M, Singh S, Agarwal S. Diagnostic utility of Ki67 and p53 immunostaining on solitary thyroid nodule – a cytohistological and radionuclide scintigraphic study. Indian J Pathol Microbiol. 2011;54(3):472-475. doi: 10.4103/0377-4929.85077.
12. Dinets A, Hulchiy M, Sofiadis A, et al. Clinical, genetic, and immunohistochemical characterization of 70 Ukrainian adult cases with post-Chornobyl papillary thyroid carcinoma. Eur J Endocrinol. 2012;166(6):1049-1060. doi: 10.1530/EJE-12-0144.
13. Lacoste-Collin L, d’Aure D, Berard E, et al. Improvement of the cytological diagnostic accuracy of follicular thyroid lesions by the use of the Ki-67 proliferative index in addition to cytokeratin-19 and HBME-1 immunomarkers: a study of 61 cases of liquid-based FNA cytology with histological controls. Cytopathology. 2014;25(3): 160-169. doi: 10.1111/cyt.12128.
14. Pallante P, Sepe R, Puca F, Fusco A. High mobility group a proteins as tumor markers. Front Med (Lausanne). 2015;2:15.
15. doi: 10.3389/fmed.2015.00015.
16. Zhou X, Benson KF, Ashar HR, Chada K. Mutation responsible for the mouse pygmy phenotype in the developmentally regulated factor HMGI-C. Nature. 1995;376(6543):771-774. doi: 10.1038/376771a0.
17. Chiappetta G, Avantaggiato V, Visconti R, et al. High level expression of the HMGI (Y) gene during embryonic development. Oncogene. 1996;13(11):2439-2446.
18. Baldassarre G, Fedele M, Battista S, et al. Onset of natural killer cell lymphomas in transgenic mice carrying a truncated HMGI-C gene by the chronic stimulation of the IL-2 and IL-15 pathway. Proc Natl Acad Sci USA. 2001;98(14):7970-7975. doi: 10.1073/pnas.141224998.
19. Xu Y, Sumter TF, Bhattacharya R, et al. The HMG-I oncogene causes highly penetrant, aggressive lymphoid malignancy in transgenic mice and is overexpressed in human leukemia. Cancer Res. 2004;64(10):3371-3375. doi: 10.1158/0008-5472.CAN-04-0044.
20. Fedele M, Pentimalli F, Baldassarre G, et al. Transgenic mice overexpressing the wild-type form of the HMGA1 gene develop mixed growth hormone/prolactin cell pituitary adenomas and natural killer cell lymphomas. Oncogene. 2005;24(21):3427-3435. doi: 10.1038/sj.onc.1208501.
21. Belton A, Gabrovsky A, Bae YK, et al. HMGA1 induces intestinal polyposis in transgenic mice and drives tumor progression and stem cell properties in colon cancer cells. PLoS One. 2012;7(1):e30034. doi: 10.1371/journal.pone.0030034.
22. Belge G, Meyer A, Klemke M, et al. Upregulation of HMGA2 in thyroid carcinomas: a novel molecular marker to distinguish between benign and malignant follicular neoplasias. Genes Chromosomes Cancer. 2008;47(1):56-63. doi: 10.1002/gcc.20505.
23. Chiappetta G, Ferraro A, Vuttariello E, et al. HMGA2 mRNA expression correlates with the malignant phenotype in human thyroid neoplasias. Eur J Cancer. 2008;44(7):1015-1021. doi: 10.1016/j.ejca.2008.02.039.
24. Lappinga PJ, Kip NS, Jin L, et al. HMGA2 gene expression analysis performed on cytologic smears to distinguish benign from malignant thyroid nodules. Cancer Cytopathol. 2010;118(5):287-297. doi: 10.1002/cncy.20095.
25. Jin L, Seys AR, Zhang S, et al. Diagnostic utility of IMP3 expression in thyroid neoplasms: a quantitative RT-PCR study. Diagn Mol Pathol. 2010;19(2):63-69. doi: 10.1097/PDM.0b013e3181b6a528.
26. Jin L, Lloyd RV, Henry MR, et al. The diagnostic utility of combination of HMGA2 and IMP3 qRT-PCR testing in thyroid neoplasms. Appl Immunohistochem Mol Morphol. 2015;23(1):36-43. doi: 10.1097/PAI.0000000000000031.
27. Nagar S, Ahmed S, Peeples C, et al. Evaluation of genetic biomarkers for distinguishing benign from malignant thyroid neoplasms. Am J Surg. 2014;207(4):596-601. doi: 10.1016/j.amjsurg.2013.06.012.
28. Jang MH, Jung KC, Min HS. The diagnostic usefulness of HMGA2, survivin, CEACAM6, and SFN/14-3-3 delta in follicular thyroid carcinoma. J Pathol Transl Med. 2015;49(2):112-117. doi: 10.4132/jptm.2015.01.31.
29. Cibas ES, Ali SZ. The Bethesda System for Reporting Thyroid Cytopathology. Thyroid. 2009;19(11):1159-1165. doi: 10.1089/thy.2009.0274.
30. Schmittgen TD, Livak KJ. Analyzing real-time PCR data by the comparative C(T) method. Nat Protoc. 2008;3(6):1101-1108.
31. Румянцев П.О., Ильин А.А., Румянцева У.В., Саенко В.А. Рак щитовидной железы. современные подходы к диагностике и лечению. – М.: ГЭОТАР-медиа; 2009. [Rumjancev PO, Il’in AA, Rumjanceva UV, Saenko VA Thyroid cancer, modern approaches to diagnosis and treatment. Moscow: GEOTAR-media; 2009 (in Russ.)].
Об авторах
Ирина Сергеевна БерезкинаРоссия
аспирант
Конфликт интересов: Конфликт интересов отсутствует
Татьяна Владимировна Саприна
Россия
д.м.н., профессор
Конфликт интересов: Конфликт интересов отсутствует
Анастасия Павловна Зима
Россия
д.м.н., профессор
Конфликт интересов: Конфликт интересов отсутствует
Анна Владимировна Исаева
Россия
аспирант
Конфликт интересов: Конфликт интересов отсутствует
Венера Насхатовна Латыпова
Россия
к.м.н., доцент
Конфликт интересов: Конфликт интересов отсутствует
Марат Рафкатович Мухамедов
Россия
д.м.н.
Конфликт интересов: Конфликт интересов отсутствует
Леонид Романович Базилевич
Россия
к.м.н.
Конфликт интересов: Конфликт интересов отсутствует
Олег Сергеевич Попов
Россия
д.м.н., профессор
Конфликт интересов: Конфликт интересов отсутствует
Дарья Александровна Скуратовская
Россия
к.м.н
Конфликт интересов: Конфликт интересов отсутствует
Кристина Алексеевна Юрова
Россия
к.м.н
Конфликт интересов: Конфликт интересов отсутствует
Лариса Сергеевна Литвинова
Россия
д.м.н.
Конфликт интересов: Конфликт интересов отсутствует
Дополнительные файлы
Рецензия
Для цитирования:
Березкина И.С., Саприна Т.В., Зима А.П., Исаева А.В., Латыпова В.Н., Мухамедов М.Р., Базилевич Л.Р., Попов О.С., Скуратовская Д.А., Юрова К.А., Литвинова Л.С. Исследование галектина-3, Ki-67, убиквитина, HMGA2 методом полимеразной цепной реакции в режиме реального времени в пункционном материале при узловом зобе. Клиническая и экспериментальная тиреоидология. 2016;12(2):19-27. https://doi.org/10.14341/ket2016219-27
For citation:
Berjozkina I.S., Saprina T.V., Zima A.P., Isaeva A.V., Latipova V.N., Muhamedov M.R., Bazilevich L.R., Popov O.S., Skuratovskaja D.A., Jurova K.A., Litvinova L.C. The study of galectin-3, Ki-67, ubiquitin, HMGA-2 by polymerase chain reaction in real time (RT-PCR) in the puncture specimens of nodular goiter. Clinical and experimental thyroidology. 2016;12(2):19-27. (In Russ.) https://doi.org/10.14341/ket2016219-27

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).





































