Обзоры
В настоящее время синдром Кушинга и его проявления хорошо изучены. При этом основными симптомами гиперкортицизма остаются ожирение, остеопороз, кардиомиопатия, атрофия мышц, истончение кожного покрова и образование багровых полос (стрий) на теле.
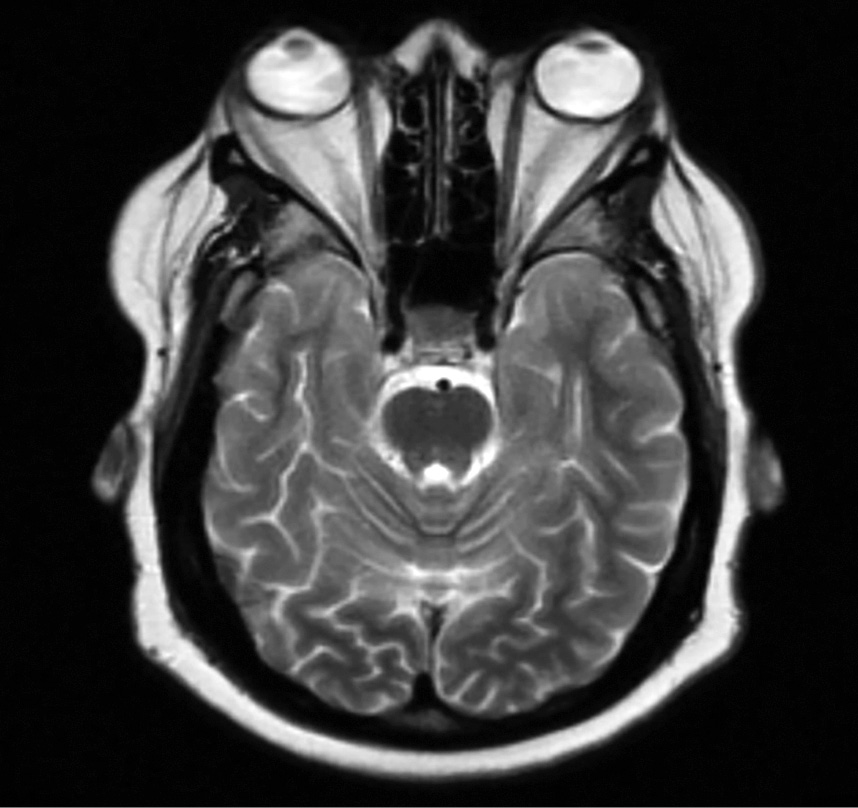
На практике самые частые из них — ожирение и остеопороз — встречаются в 90% случаев. Однако есть ряд пациентов с неявной клинической картиной гиперкортицизма. Часть изменений, наблюдаемых у них, затрагивает глаза. В данной обзорной статье рассматривается редкий симптом гиперкортицизма — экзофтальм. Экзофтальм — это патологическое смещение глазного яблока вперед. Этот симптом известен нам в рамках эндокринной орбитопатии, развивающейся при аутоиммунной патологии щитовидной железы. В статье проводится сравнение механизмов развития глазных симптомов при синдроме Кушинга и болезнях щитовидной железы, в особенности при болезни Грейвса. Обсуждаются возможные молекулярные механизмы, приводящие к экзофтальму у пациентов с синдромом Кушинга. Изучаются факторы, влияющие на адипогенез in vitro и in vivo, в частности факторы, приводящие к увеличению жировой клетчатки орбит на фоне повышенного уровня кортизола. Представлены гормональные сигнальные и транскрипционные каскады, отвечающие за дифференцировку адипоцитов в зрелые жировые клетки. Также в статье рассмотрены другие орбитальные проявления гиперкортицизма, встречающиеся на практике относительно редко. К ним относятся глаукома, а также катаракта, узелки Лиша и центральная серозная хориоретинопатия. Рассмотрены клинические случаи синдрома Кушинга с различными глазными проявлениями и сделаны соответствующие выводы.
Известно, что щитовидная железа (ЩЖ) из всех органов эндокринной системы чаще всего подвергается аутоиммунным поражениям за счет особенностей эмбриогенеза, в связи с чем зоной интересов исследователей из всех стран мирового сообщества является изучение аутоиммунных звеньев патогенеза рака щитовидной железы. Познание очевидно возможных взаимовлияний молекулярно-генетических, гормональных, иммунных факторов, лежащих в основе развития и прогрессирования эндокринных опухолей, в первую очередь рака ЩЖ, исключительно важно для создания и применения инновационных методов лечения в онкоэндокринологии. Сегодня дискуссионным остается вопрос о том, считать ли аутоиммунные заболевания потенциальной причиной онкологических процессов или, напротив, в ряде случаев рассматривать их в качестве протективных состояний при некоторых видах злокачественных опухолей. В частности, интересной моделью для изучения этих сложных взаимоотношений являются аутоиммунные тиреопатии и папиллярный рак ЩЖ. Целью данной статьи являются обсуждение накопленного опыта, рассмотрение обзора литературы, посвященного изучению иммунологических аспектов в патогенезе папиллярного рака ЩЖ, переосмысление полученного материала и формирование вывода.
Оригинальное исследование
Обоснование. В статье представлены результаты проведенного в сентябре 2020 г. специалистами ФГБУ «НМИЦ эндокринологии» Минздрава России контрольно-эпидемиологического исследования, направленного на оценку современного состояния йодной обеспеченности населения Республики Крым. Исследование в Крыму входит в ряд мероприятий и работ, выполняемых по поручению Министерства здравоохранения РФ в рамках государственных заданий «Научная оценка необходимости принятия дополнительных нормативных правовых и иных мер по ликвидации йодного дефицита в пилотных регионах с тяжелым йодным дефицитом» и «Эпидемиологические и молекулярно-клеточные характеристики опухолевых, аутоиммунных и йододефицитных тиреопатий как основа профилактики осложнений и персонализации лечения».
Полученные данные отображают состояние проблемы потребления йода на территории Крымского полуострова и свидетельствуют об актуальности принятия региональной профилактической программы, направленной на устранение дефицита йода в питании населения и связанных с ним заболеваний.
Цель. Оценка йодной обеспеченности населения Республики Крым.
Материалы и методы. Исследование проводилось в общеобразовательных школах четырех районов Республики Крым — в гг. Симферополь, Белогорск, Бахчисарай и Саки.
Объем исследования — 356 школьников 8-10 лет, всем было выполнено: сбор анамнеза и антропометрических показателей (рост, вес), осмотр врача-эндокринолога с пальпацией щитовидной железы (ЩЖ), ультразвуковое исследование (УЗИ) ЩЖ, получение разовых порций мочи и образцов пищевой поваренной соли (5-10 г), которая ежедневно используется в питании в их семьях. Измерения роста и веса детей стандартной методикой проводились во время осмотра специалистом. УЗИ ЩЖ выполнялось в положении лежа с использованием портативного ультразвукового аппарата LOGIQe (China) с мультичастотным линейным датчиком 10-15 МГц. Все образцы мочи (n=356) в одноразовых микропробирках типа Эппендорф сразу же после получения подвергались заморозке при температуре -20-25°С для дальнейшего определения концентрации йода в моче с помощью церий-арсенитного метода (на базе клинико-диагностической лаборатории ФГБУ «НМИЦ эндокринологии» Минздрава России). Качественное исследование на наличие йодата калия в образцах пищевой поваренной соли (n=203) осуществлялось на месте экспресс-методом.
От всех родителей/опекунов детей получены информированные согласия на проведение обследования и обработку персональных данных. Разрешение локального этического комитета ФГБУ «НМИЦ эндокринологии» Минздрава России получено 25 марта 2020 г., №5.
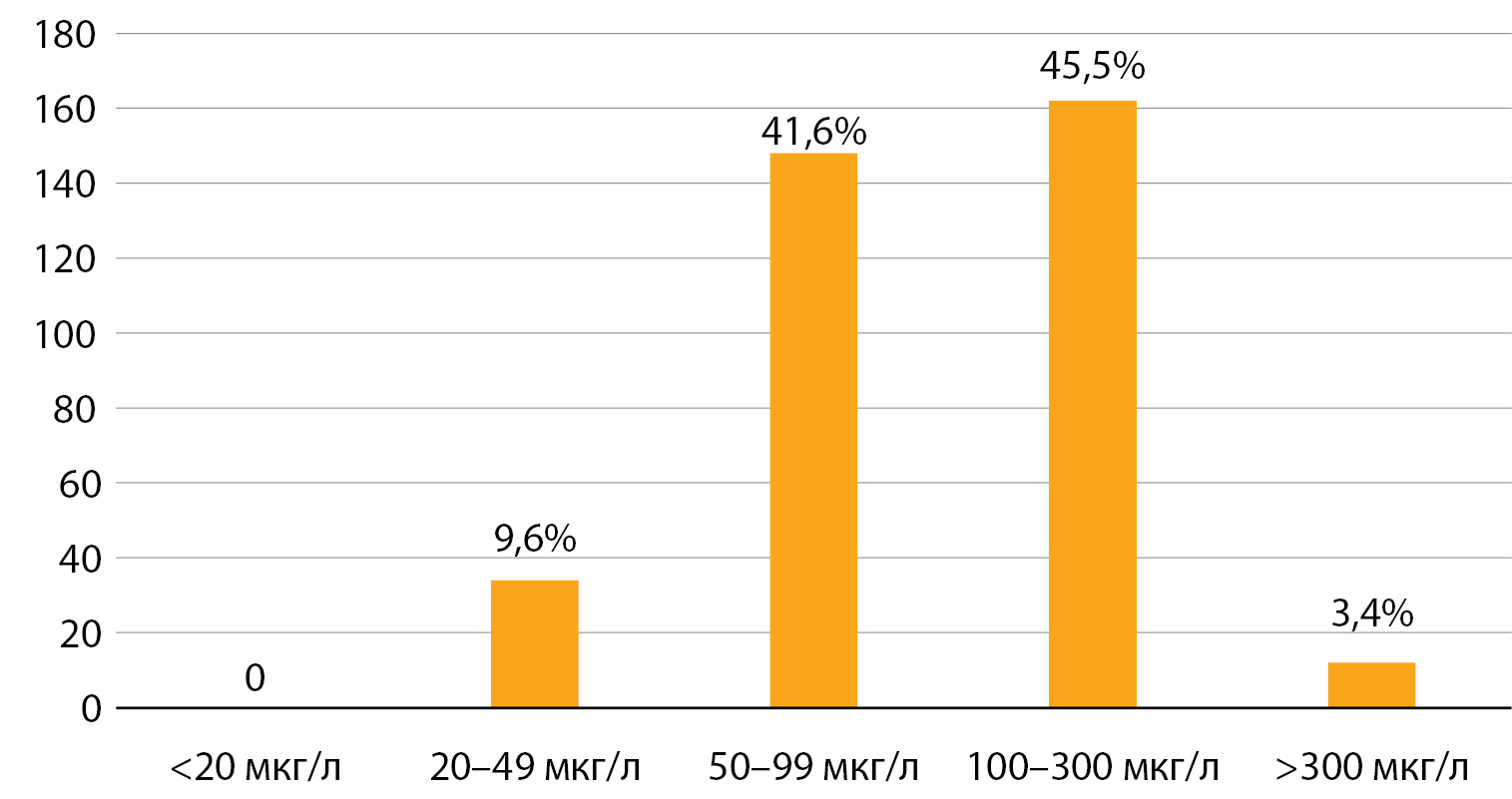
Результаты. По результатам обследования 356 детей младшего школьного возраста медианная концентрация йода в моче (мКЙМ) составляет 97 мкг/л и варьирует от 78 до 98 мкг/л в обследованных районах, доля проб мочи со сниженной концентрацией йода составила 51,2%. Доля использования в семьях школьников йодированной соли составила 12,3% (диапазон значений от 10 до 15%). Средняя частота распространенности зоба у детей по данным УЗИ — 9,5% (диапазон значений от 1,7 до 16,3%).
Заключение.
- Показатель медианной концентрации йода в моче свидетельствует о недостаточной йодной обеспеченности населения Республики Крым.
- Распространенность зоба у детей младшего школьного возраста по данным УЗИ ЩЖ соответствует легкой степени тяжести йодного дефицита в регионе.
- Доля домохозяйств, использующих йодированную соль, крайне низкая, и составляет 12,3%, что не соответствует рекомендациям ВОЗ для регионов с природным дефицитом йода (от 90% и более).
Background: Thyroid stimulating hormone (TSH) and thyroxine levels may change according to fasting — satiety status. AIM: The aim of this study was to determine the effect of satiety on TSH and free thyroxine levels.
Methods: This study was conducted in a tertiary hospital. According to previous TSH and thyroxine levels, groups of 30, 30 and 60 participants were designated as subclinical hypothyroidism, hypothyroidism, and control groups respectively. To obtain TSH and thyroxine results first phlebotomy was performed at 8 am while participants were in fasting state. Then participants were allowed to have non-standardized breakfast. Second phlebotomy was performed at 10 am while participants were in non-fasting state. Paired t-test and ANOVA were used to analyze the data.
Results: The fasting TSH levels of the participants (2.57 ± 1.84 mlU/L) were significantly higher than the satiety TSH levels (2.04 ± 1.48 mlU/L) (t = 8.566, p < 0.001, d = 0.80). The fasting free thyroxine values (1.31 ± 0.38 mg/dl) of the participants were significantly lower than the satiety free thyroxine values (1.39 ± 0.35 mg/dl) (t = -1.988, p = 0.049, d = 0.20).
Conclusion: Knowing how TSH and free thyroxine tests are affected by satiety has the power to affect treatment of many patients. Our study has shown that both TSH and free thyroxine levels changed significantly according to satiety status.

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).
ISSN 2310-3787 (Online)